在生物制药领域,无菌过滤工艺是确保最终产品质量和安全性的关键环节之一。其中,用于去除细菌和控制生物负荷的除菌过滤系统一直是无菌过滤工艺中的重要环节。
PUPSIT定义
根据EU 新版 GMP 的相关规定“8.87 The integrity of the sterilised filter assembly should be verified by integrity testing before use (pre-use post sterilisation integrity test or PUPSIT), to check for damage and loss of integrity caused by the filter preparation prior to use.”
PUPSIT,即“使用前、灭菌后完整性测试”(Pre-Use Post-Sterilization Integrity Test),是无菌制药工艺中的一项重要测试措施。
由于灭菌过程可能会对过滤器产生影响,如导致微小破损、孔径变化,或引入“掩盖缺陷”的风险,PUPSIT帮助制药企业在生产启动之前确认过滤器是否能有效地过滤微生物和其他颗粒,确保产品的最终无菌性。
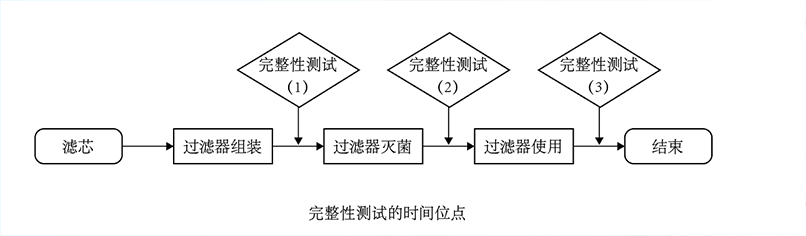
实施要点
1. 测试时机与流程设计
严格时序:必须在过滤器完成灭菌(如湿热灭菌、辐照灭菌)后,且在实际使用(如药液过滤、无菌工艺)前进行,避免灭菌后二次污染或操作损伤。
无缝衔接:若灭菌后无法立即测试(如过滤器已安装于系统),需确保测试前系统处于密闭状态,防止外界污染。
2. 灭菌方法兼容性
湿热灭菌(SIP):需验证高温高压对滤膜(如PES、PVDF)的影响,避免膜孔径变形或密封件老化。
辐照灭菌:注意γ射线或电子束可能降低滤膜机械强度,需通过完整性测试确认无损伤。
环氧乙烷(EO)灭菌:需彻底解析残留气体,避免影响测试结果(如扩散流测试干扰)。
3. 完整性测试方法选择
起泡点测试(Bubble Point):适用于膜孔径较大(≥0.2μm)的除菌过滤器,需设定灭菌前后的阈值(如0.2μm滤膜起泡点≥3.5 bar)。
扩散流/前进流测试(Diffusion Flow):更敏感,适用于小孔径或多层滤膜,需根据滤膜材质和灭菌条件校准标准值。
压力衰减测试(Pressure Hold):适用于在线测试,需确保系统密闭性(如管路、接头无泄漏)。
4. 测试系统设计
在线测试 vs. 离线测试:
在线测试:直接在生产系统中进行,需验证测试设备(如完整性测试仪)与工艺管路的兼容性。
离线测试:适用于小型或独立过滤器,需确保拆卸-测试-重新安装过程的无菌性。
自动化集成:优先采用自动化测试设备,减少人为操作误差,确保数据完整性(如电子记录符合ALCOA+原则)。
5. 验证与接受标准
灭菌前后对比:需建立灭菌前(出厂)与灭菌后(PUPSIT)的完整性测试数据基线,确认灭菌过程未导致性能漂移。
接受标准:依据过滤器厂家标定值,结合工艺验证数据设定(如扩散流≤10 mL/min·cm²)。
失败处理:若测试失败,需启动偏差调查(是否为灭菌损伤、安装不当或测试误差),并更换过滤器。
风险评估与关键控制
风险点:灭菌参数超限(如温度过高)、过滤器安装不当(如O型圈损坏)、测试环境(如非洁净区操作)。
控制措施:通过工艺验证(如灭菌循环验证)、操作SOP培训、环境监控(如粒子计数)降低风险。
法规与文件要求
GMP/FDA合规:符合FDA《无菌工艺指南》、EU GMP Annex 1(2022)要求,明确PUPSIT为强制步骤。
•欧盟GMP附录1:2022年发布的新版附录1明确要求,在没有显著工艺限制(如溶液体积较小)的情况下,制药企业必须在使用前对灭菌后的除菌过滤器进行PUPSIT测试。这不仅是为了防止微生物污染,还因灭菌过程可能导致滤器的完整性下降,从而影响药品的无菌质量。
•美国FDA:FDA的相关指南虽然未明确要求所有情况下必须执行PUPSIT,但强调根据产品特性进行风险评估,并在必要时执行完整性检测。对于那些无法在灭菌后实施PUPSIT的产品,需基于科学依据采取其他风险控制措施。
•WHO和PIC/S:全球化的GMP指南如WHO和PIC/S同样支持PUPSIT,特别是针对出口或跨国销售的无菌药品,要求严格执行PUPSIT的流程,以确保最终产品质量达到国际标准。

文件记录:需完整记录灭菌参数、测试结果、操作人员、设备编号等信息,支持产品批次放行。
审计重点:检查测试数据趋势分析、偏差记录、过滤器更换频率是否合理。
典型案例应用
注射液除菌过滤:在线PUPSIT确保药液过滤前过滤器完整性。
生物反应器进气过滤器:灭菌后测试防止细胞培养污染。
无菌包装器械:测试呼吸袋过滤器是否在EO灭菌后仍维持无菌屏障。
总结
PUPSIT是保障无菌工艺安全的核心环节,需通过科学的验证、严格的流程控制和合规的文件管理实现。实施时应结合具体工艺特点(如灭菌方式、过滤器类型),确保测试结果的可靠性与重现性。